Zadania powtórkowe ze stałej równowagi
- Reakcja tlenku węgla(II) z parą wodną przebiega zgodnie z równaniem:
CO(g) + H2O(g) ⇌ H2(g) + CO2(g)
W temperaturze T stężeniowa stała równowagi tej reakcji jest równa 2,0. W zamkniętym reaktorze o stałej pojemności znajdowało się 0.3 mola tlenku węgla(II), 1 mola pary wodnej i 1.5 mola wodoru. Mieszaninę utrzymywano temperaturze T aż do osiągnięcia stanu równowagi dynamicznej przez układ.
Oblicz liczbę moli każdej substancji znajdującej się w reaktorze po ustaleniu się stanu równowagi opisanej reakcji. - Reakcja tlenku węgla(II) z parą wodną przebiega zgodnie z równaniem:
CO(g) + H2O(g) ⇌ H2(g) + CO2(g)
W temperaturze T stężeniowa stała równowagi tej reakcji jest równa 10. W zamkniętym reaktorze o stałej pojemności znajdowało się 1 mol tlenku węgla(II), 1 mol pary wodnej, 1 mol tlenku węgla(IV) i 1mol wodoru. Mieszaninę utrzymywano temperaturze T aż do osiągnięcia stanu równowagi dynamicznej przez układ.
Oblicz liczbę moli każdej substancji znajdującej się w reaktorze po ustaleniu się stanu równowagi opisanej reakcji.
Odpowiedzi
W tym wypadku nie musimy sprawdzać, w którą stronie będzie szła reakcja, ponieważ w stanie początkowym nie ma CO2, więc reakcja musi iść stronę produktów.
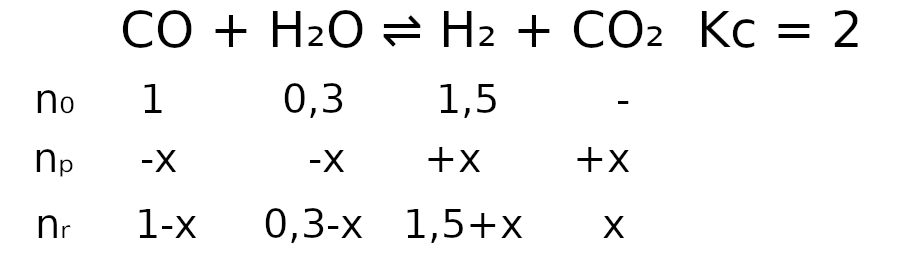
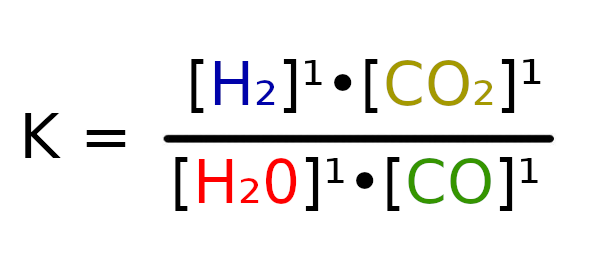
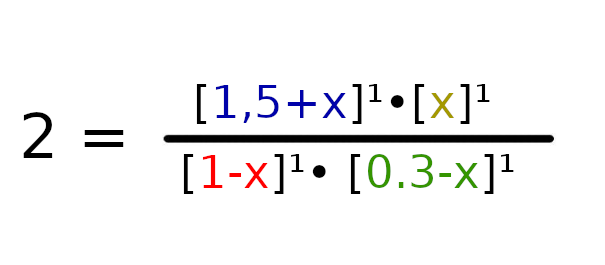
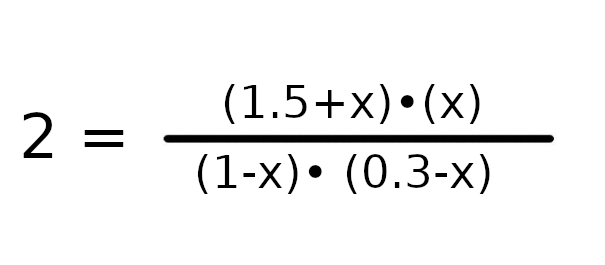
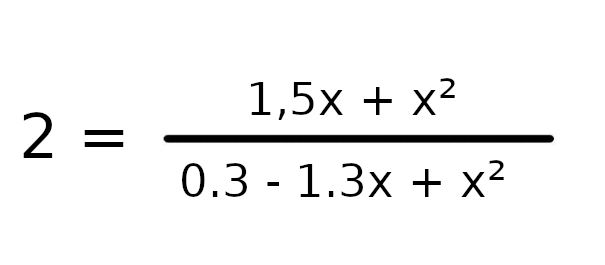
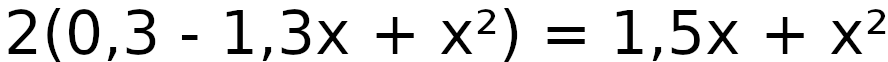
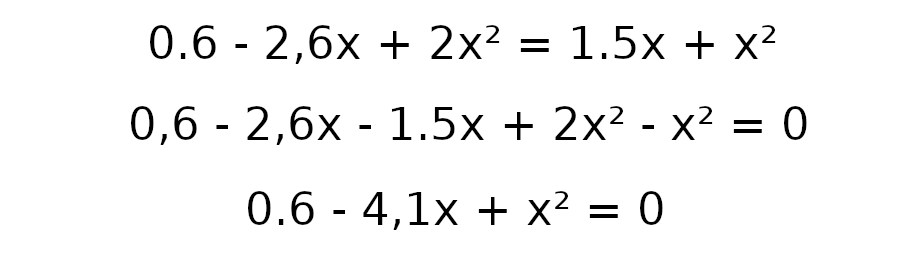
a = 1
b = -4.1
c = 0.6
Δ = b² – 4ac
Δ = (-4,1)² – 4 • 1 • 0,6
Δ = 16,81 – 2,4
Δ = 14.41
√Δ = ~3.80
Δ > 0
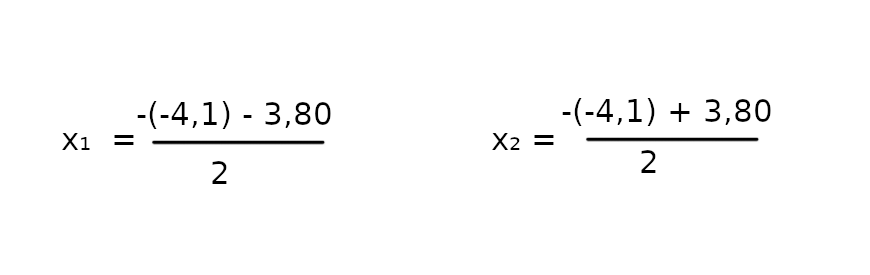
x₁ = 0.15
x₂ = 3,95
x₂ da wyniki ujemne więc odrzucamy je
x = 0.15
CO = 1 – 0.15 = 0.85
H2O = 0.3 – 0.15 = 0.15
H2 = 1.5 + 0.15 = 1.65
CO2 = 0.15
W tym wypadku łatwo policzyć, że współczynnik Q będzie równy 1. Czyli K > Q, więc reakcja będzie szła w stronę produktów.
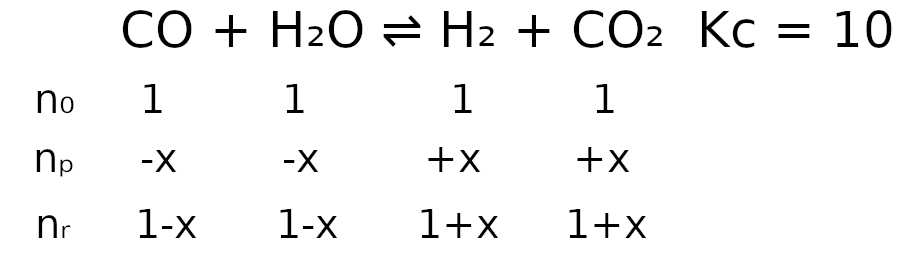
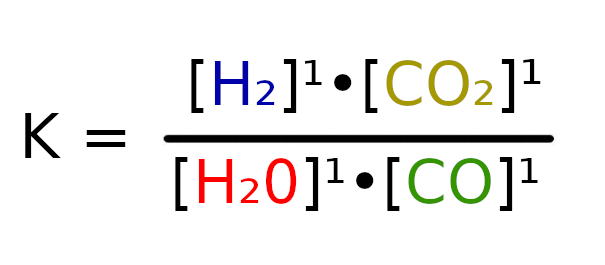
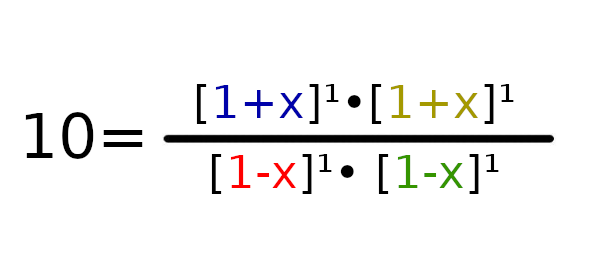
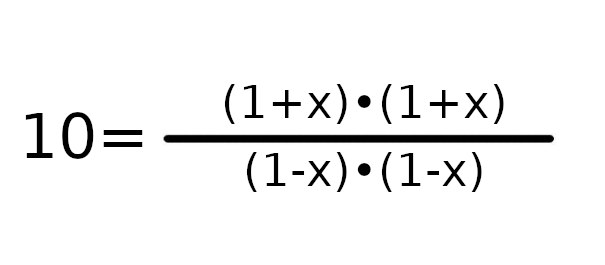
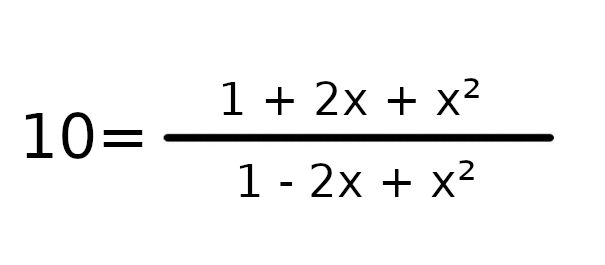
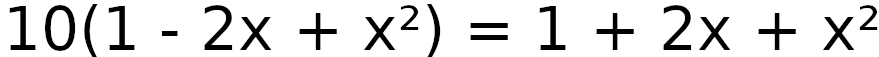
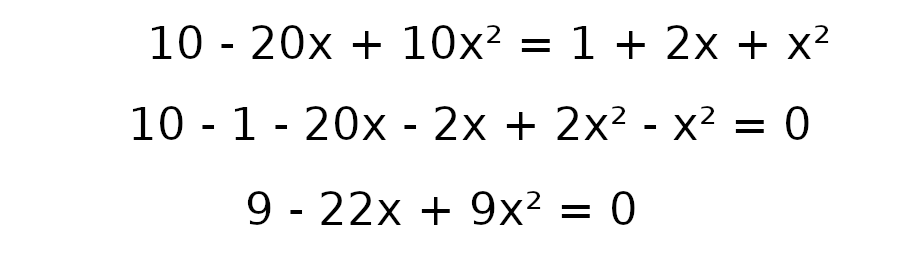
a = 9
b = -22
c = 9
Δ = b² – 4ac
Δ = (-22)² – 4 • 9 • 9
Δ = 484 – 324
Δ = 160
√Δ = ~12.65
Δ > 0
x₁ = ~0.52
x₂ = ~1.93
x₂ da wyniki ujemne więc odrzucamy je
x = 0.52
CO = 1 – 0.52 = 0.48
H2O = 1 – 0.52 = 0.48
H2 = 1 + 0.52 = 1.52
CO2 = 1 + 0.52 = 1.52


0 Komentarzy