Zadanie ze stałej równowagi chemicznej
Dzisiaj, przerobimy przykład, na którym nauczymy się jak wyliczyć stężenia w stanie równowagi, mając tylko początkowe stężenia reagentów i stała równowagi. Podobne obliczenia w rozmaitych zadań często sprawia problem, więc właśnie dziś omówimy krok po kroku dojście do wyniku i ewentualnie pułapki, jakie czekają na nas.
Przed rozpoczęciem czytania warto powtórzyć sobie pojęcie delty z matematyki i jak ją wyliczyć.
Zadanie
Reakcja tlenku węgla(II) z parą wodną przebiega zgodnie z równaniem:
CO(g) + H2O(g) ⇌ H2(g) + CO2(g)
W temperaturze T stężeniowa stała równowagi tej reakcji jest równa 2,0.
W zamkniętym reaktorze o stałej pojemności zmieszano 1.5 mol tlenku węgla(II) z parą wodną ilości trzykrotnie większej od ilości stechiometrycznej. Mieszaninę utrzymywano temperaturze T aż do osiągnięcia stanu równowagi dynamicznej przez układ.
Oblicz liczbę moli każdej substancji znajdującej się w reaktorze po ustaleniu się stanu równowagi opisanej reakcji.
Na początku musimy ustalić, od czego zaczynamy. Z równania wynika, że objętość jest stała, to znaczy, że możemy założyć jej wartość. Na potrzeby obliczeń możemy założyć, że objętości jest tyle, że liczba moli reagenta jest równa stężeniu molowemu tego reagenta. Rozpiszmy sobie dane:
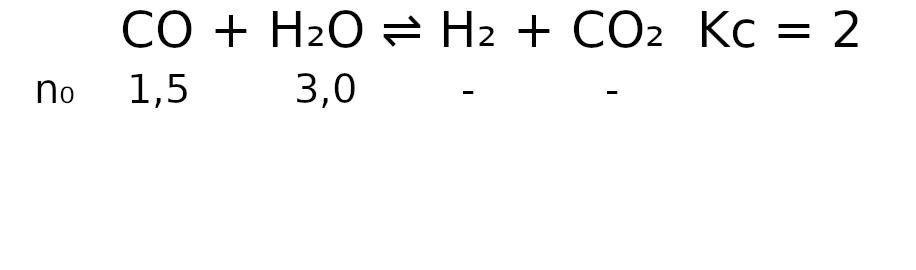
n₀ oznacza ilość moli na początku reackji jakie miały poszczególne reagenty. W zadaniu mamy wprost napisane, że w reaktorze jest 1,5 mola CO. Mam również podane, że pary wodnej jest 3 razy więcej niż jej ilości stechiometrycznej. W równaniu widzimy, że przed H2O nie ma żadnej liczby, więc liczba stechiometryczna pary wodnej jest równa 1. Mnożąc tę liczbę przez 3, otrzymujemy wynik równy 3 molom. W zadania również nie jest wspomniane ile jest moli H2 i CO2, więc uznajemy, że ich nie ma na początku reakcji.
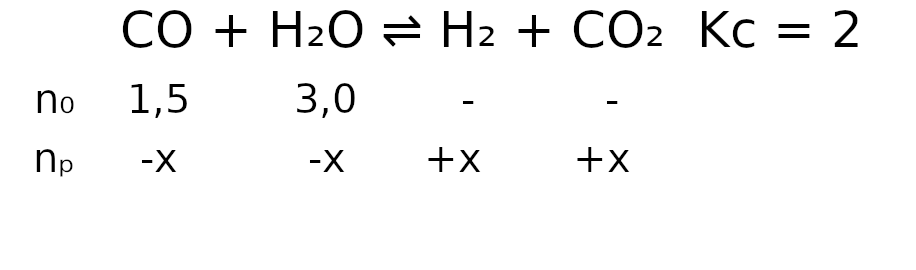
nₚ oznacza ile przereagowało moli i ile ich powstało. Jeżeli w reaktorze na początku reakcji znajdowałyby się jeszcze produkty tej reakcji, czyli H2 i CO2 to musielibyśmy obliczyć współczynnik Q. Współczynnik ten wskazuje, w którą stronę przebiegnie reakcja. Więcej o nim powiemy w innym artykule, ponieważ teraz wiemy, że mamy tylko substraty, które przereagują. Stosunek substratów do produktów jest równy 1:1. Więc wiemy, że jeżeli przereaguje x substratów to powstanie x produktów. Jeżeli stosunek np. 1:2 to z x powstawało 2x produktów.
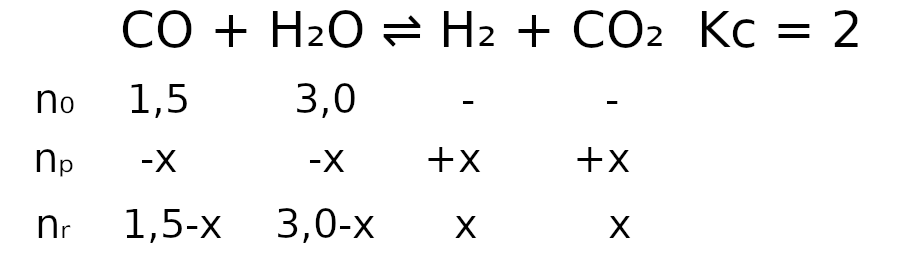
nr oznacza ile jest moli w stanie równowagi. Od substratów odejmujemy ilość, która przereagowała. Dla ułatwienia podłóżmy do wzoru na stałą równowagi jak w ostatnim artykule.
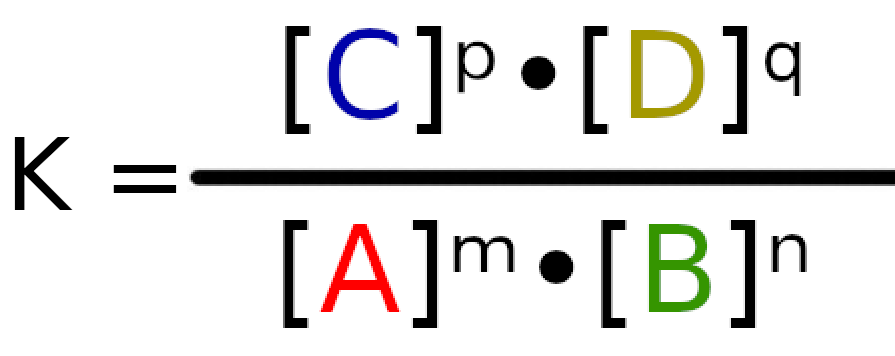
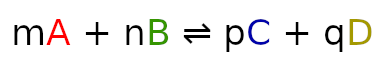
Teraz podstawmy do powyższą reakcję do wzoru.
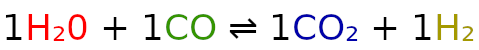
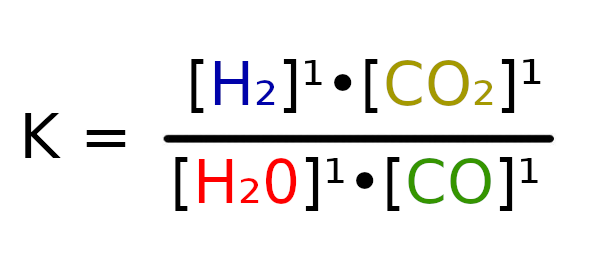
Pod stałą równowagi i odpowiednie reagenty podstawmy ich stężenia.
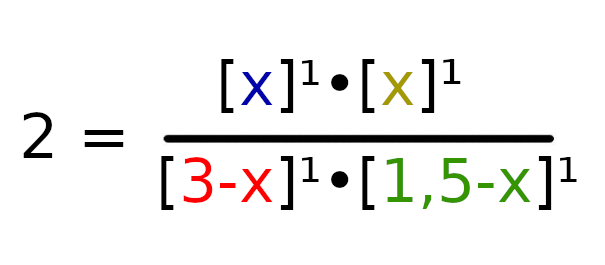
Przekształćmy równanie i usuńmy niepotrzebne potęgi.
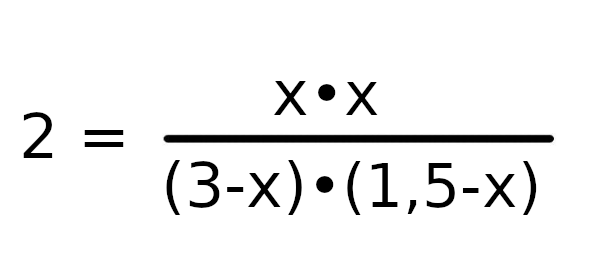
Dokonajmy teraz obliczeń w mianowniku, żebyśmy mogli łatiwej przekształcić równanie.
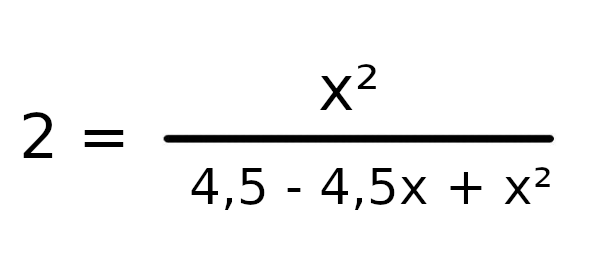
W celu usunięcia ułamka musimy równanie pomnożyć obustronnie o wartość mianownika, czyli o wartość 4,5 – 4,5x + x².
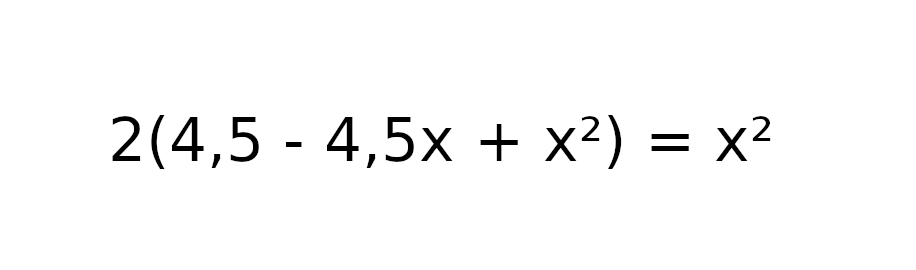
Usuńmy nawias mnożąc jego wartość przez 2 i przenieśmy x² na drugą stronę równania tak, aby po prawej stronie zostało 0.
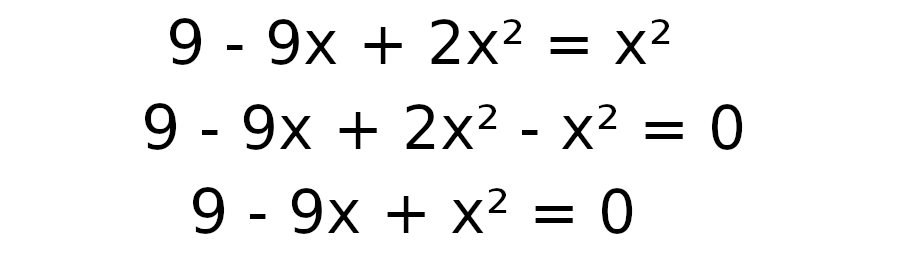
Doprowadzanie do takiego równanie pozwoli nam z łatwością obliczyć deltę.
a = 1
b = -9
c = 9
Przypomnij wzór na deltę Δ = b² – 4ac.
Δ = (-9)² – 4 • 1 • 9
Δ = 81 – 36
Δ = 45
√Δ = ~6.71
Wiemy, że delta jest większą od 0, więc możemy sobie przypomnieć 2 wzory na wyznaczenie miejsc zerowych.
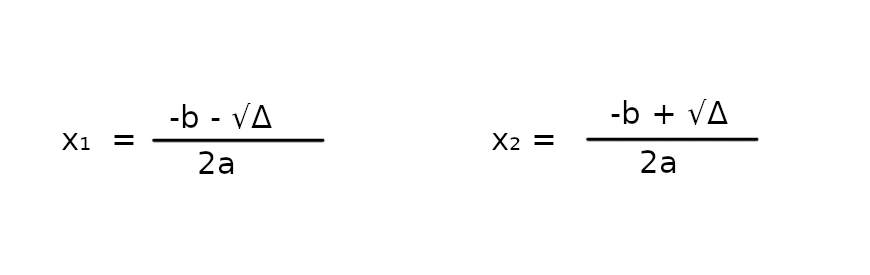
Podłóżmy dane pod oba wzory.
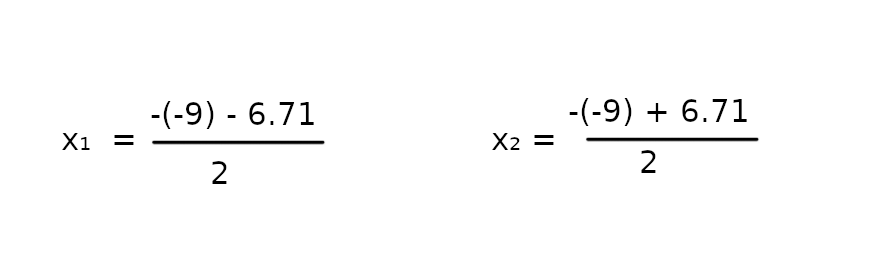
x₁ = ~1,15
x₂ = ~7,96
Powstaje tu pytanie, który teraz wynik jest prawdziwy? Łatwo to sprawdzić podstawiając pod x pod dowolne równanie. Jeżeli x₂ jest poprawny to jakie stężenie będzie miał przykładowo para wodna H2O. Jej początkowe stężenie wynosiło 3 więc jeżeli odejmiemy od niej 7,96, wyjdzie, że w stanie równowagi ma stężenie – 4.96. To od razu nam mówi, że tylko drugie rozwiązanie jest prawidłowe. Sprawdźmy, jakie są więc stężenia:
x = 1,15
CO = 1,5 – 1,15 = 0.35
H2O = 3,0 – 1,15 = 1,85
H2 = 1,15
CO2 = 1,15
Zgodnie z naszym założeniem o objętości w reaktorze te stężenia są również ilością moli. Tak więc podane wyniki są już gotową odpowiedzią do zadania.
Podsumowanie
Jest to jeden przykład z wielu zadań związanych ze stałą równowagi. W przyszłości poruszymy więcej wariantów takich zadań, jakie mogą nas spotkać. Możecie się również spodziewać w przyszłości aplikacji, która wam pomoże zrozumieć takie działania 🙂



0 Komentarzy