Stała równowagi chemicznej
W dzisiejszym artykule przeanalizujemy wzór na stałą równowagi. Rozwiążemy parę przykładów, które pozwolą nam zrozumieć lepiej temat.
Definicja
Stała równowagi – współczynnik równy ilorazowi reakcji, opisujący stan równowagi odwracalnych reakcji chemicznych.
Rozbijmy definicję na czynniki pierwsze.
iloraz reakcji – stosunek stężeń molowych substratów do produktów.
Aby obliczyć iloraz reakcji należy:
dla reakcji wyrażonej wzorem:
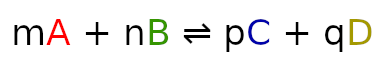
iloraz wynosi:
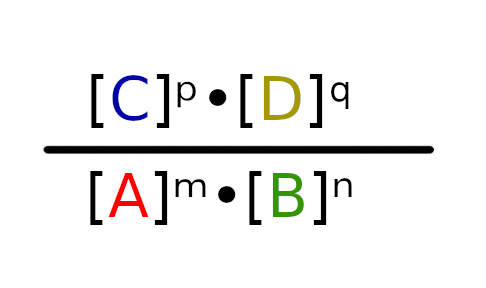
Pod literami A, B, C i D, kryją się nazwy związków chemicznych, które biorą udział w reakcji np. H2O, O2, Cl2. W ilorazie są to stężenie molowych związków w danej reakcji.
Litery m, n, p i q symbolizują współczynniki stechiometryczne dla danej reakcji. W ilorazie podnoszą do potęgi stężenia molowe.
W chemii wszystkie reakcje są odwracalne, czyli reakcje odbywają się w kierunku tworzenia substratów i produktów jednocześnie. Jednak istnieją reakcje, których produkty prawie w zerowym stopniu przemieniają się z powrotem do substratów i takie reakcje nazywany nieodwracalnymi.
Przykład
Dla lepszego zrozumienia rozpiszemy wszystkie te symbole dla reakcji:
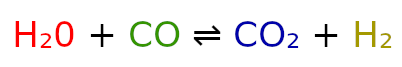
Jeżeli, przed danym składnikiem nie ma żadnego numeru stechiometrycznego, to wstawiamy 1.
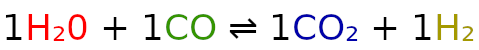
A = H2O
B = CO
C = CO2
D = H2
m = 1
n = 1
p = 1
q = 1
Zapis stałej równowagi
Stała równowagi zapisujemy znakiem K, więc wyrażenie na stałą równowagi ma postać:
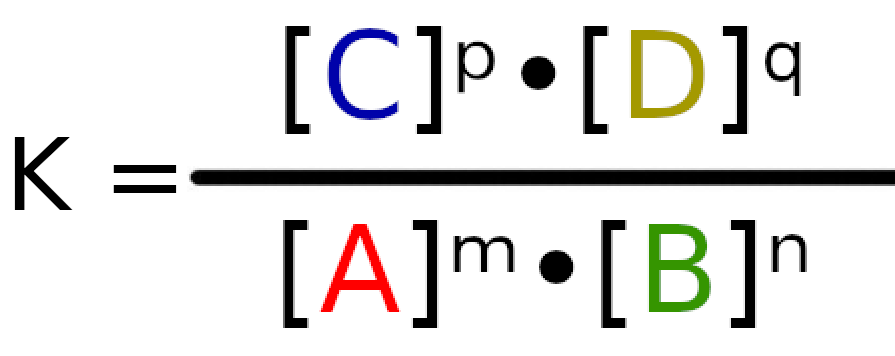
Z definicji wiemy też, że stała ta opisuje tylko stan równowagi, czyli stan, w którym szybkość tworzenie produktów jest równa szybkości tworzenia substratów.
Załóżmy, że po ustaleniu równowagi w reakcji z przykładu powyżej, wszystkie substraty i produkty będą miały te samo stężenie równe 1 mol/dm³.
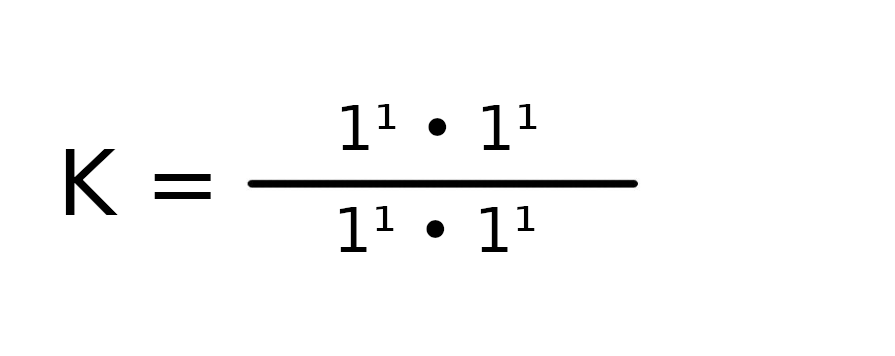

Stała równowagi tej reakcji jest równa 1. Musimy zapamiętać, że ta wartość nie jest stała, ponieważ w zależności od temperatury może przyjmować różne wartości. Mamy jednak pewność, że zawsze w takich samych warunkach stała będzie niezmienna.
Omówmy teraz na przykładzie reakcji N2 + 3H2 → 2NH3 , w której wszystkie produkty i substraty mają stężenie 0,5 mol/dm³ w stanie równowagi.
Widzimy, że produktem powyżej reakcji jest tylko amoniak (NH3). W takim wypadku wzór reakcji będzie wyglądał następująco:
Teraz podłóżmy pod odpowiednie litery odpowiednie wartości.

Podane równanie w iloczynie będzie wyglądało następująco:
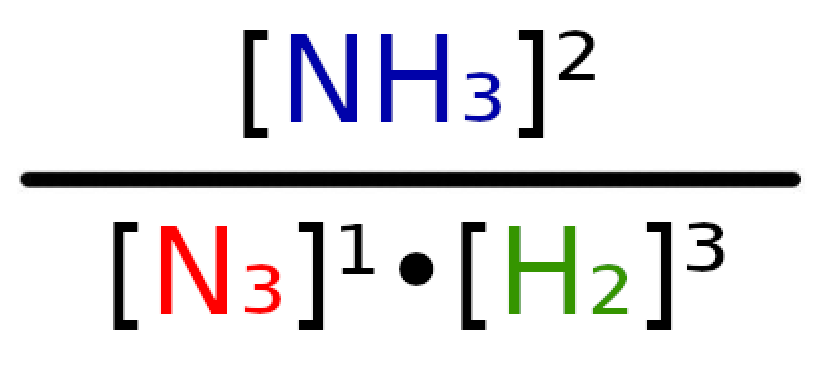
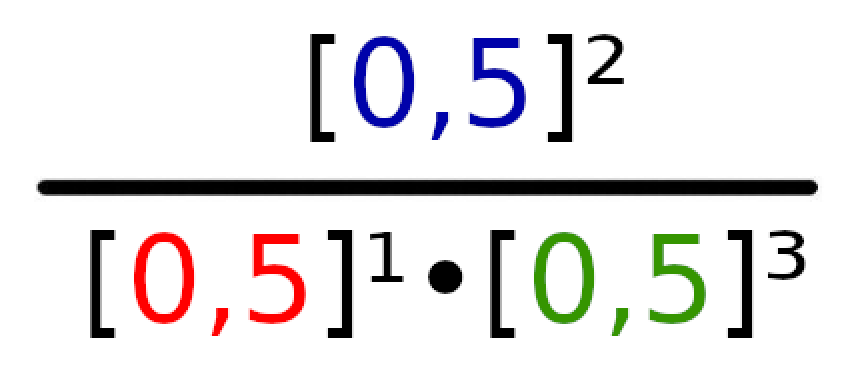
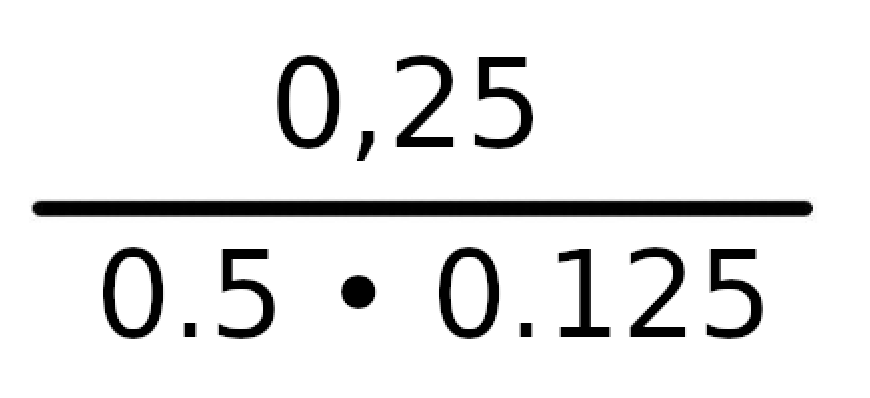
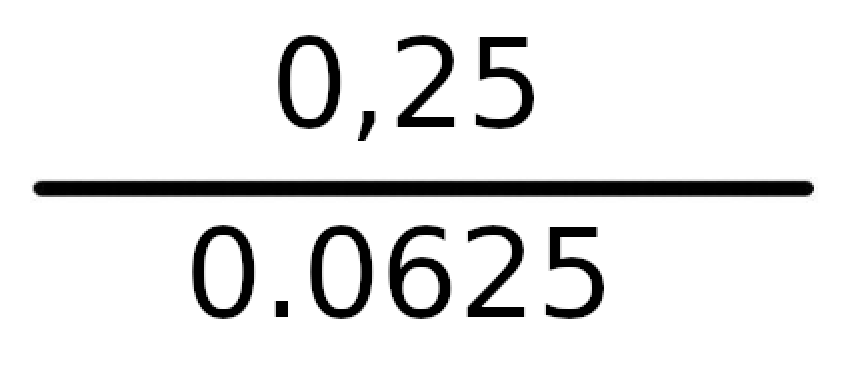
Dzieląc 0,25 przez 0,0625, wyjdzie nam wynik 8 i ten właśnie wynik jest naszą wartością K.
Znaczenie stałej równowagi
Stała równowagi ma dawać nam informację o stężeniach produktów i substratów. Im większe jej wartość, tym więcej jest produktów, ale łatwo dostrzec, że ta sama wartość liczbowa stałej niesie inną informację w zależności od reakcji chemicznej.
Sprawdźmy jakie stężenia będą miały substraty i produkty w dwóch różnych reakcjach chemicznych i załóżmy, że K = 1.
W reakcji N2 + 3H2 → 2NH3, w stanie równowagi substraty i produkty dla podanej stałej równowagi, będą miały stężenia równe 1 mol/dm³. W takim wypadku suma stężenia produktów będą wynosiły 2 mol/dm³ a produktów tylko 1 mol/dm³.
W reakcji H2O + CO = CO2 + H2, w stanie równowagi substarty również będą miały steżenia równe 1 mol/dm³. Jednak różnica polega na tym, że substraty i produkty będą miały te same stężęnie czyli 2 mol/dm³.
Jak wtedy interpretować wynik? Tak naprawdę stała równowagi niesie sprecyzowaną informację, jeżeli jej wartość jest bardzo duża lub bardzo mała. Przykładowo K = ~100 to znacznie więcej będzie produktów niż substratów, a jeśli K = 0,001 to więcej powstanie substratów w danej reakcji.
Podsumowanie
Ważne pojęcia do zapamiętania:
Stała równowagi – współczynnik równy ilorazowi reakcji, opisujący stan równowagi odwracalnych reakcji chemicznych. Stała nie wyraża się w żądnej jednostce.
Równowaga – stan, w którym prędkość reakcji powstawanie produktów jest równa prędkości reakcji tworzenia substratów.
Odwracalna reakcja może zachodzić w obie strony – od substratów do produktów i na odwrót.
Nieodwracalna reakcja zachodzi głównie w stronie produktów i prawie w żadnym stopniu w stronę substratów.
0 Komentarzy