Stała równowagi na maturze
Polecamy najpierw samemu spróbować rozwiązać zadanie.
Maj 2019
Zadanie 7. (0–2)
W reaktorze o stałej pojemności znajdowały się tlenek węgla(II) i para wodna zmieszane w stosunku masowym 1 : 1, a sumaryczna liczba moli tych reagentów była równa 20. Stężeniowa stała równowagi reakcji
CO(g) + H2O(g) ⇌ H2(g) + CO2(g)
w warunkach prowadzenia procesu wynosi 1. Oblicz, ile moli wodoru znajdowało się w reaktorze po osiągnięciu stanu równowagi przez układ.
Zacznijmy standardowo od ustalenia ilości reagentów na początku reakcji.
W zadania jest napisane, ze stosunek masowy wynosi 1:1. Łatwo można popełnić w tym momencie błąd, zakładając, że w reaktorze znajduje się po 10 moli H2O i CO. Mol wyraża ile drobin (atomów, cząsteczek) znajduje się w układzie, ale każda drobina może mieć inną masę. Cząsteczka pary wodnej H2O składa się z dwóch wodorów ważących po jednym 1u i jednym tlenie ważącego 16u dając łącznie 18u, a cząsteczka tlenku węgla łącznie waży 28u.
Nasz stosunek mas jest równy 18 : 28. Mamy tutaj (18 + 28) 46 części składowych, więc należy obliczyć, jaki to stosunek procentowy.
1 / 46 = ~2.17%
% H2O: 18 * 2,17% = ~39,1%
% CO: 28 * 2,17% = ~60.9%
Teraz musimy obliczyć ile moli przypada na każdą cząsteczkę.
m H2O: 39.1% * 20 = ~7.8
m CO: 60.0% * 20 = ~12.2
Znając już liczbę moli reagentów, możemy rozpocząć obliczenia.
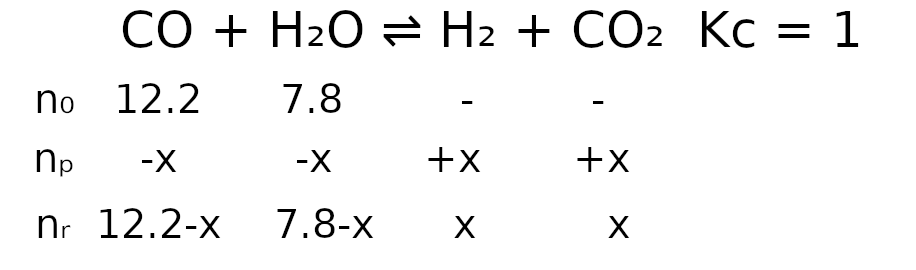
W zadaniu jest podana informacja, że objętość jest stała, więc działania na stężeniach są równoznaczne z działaniami na molach.
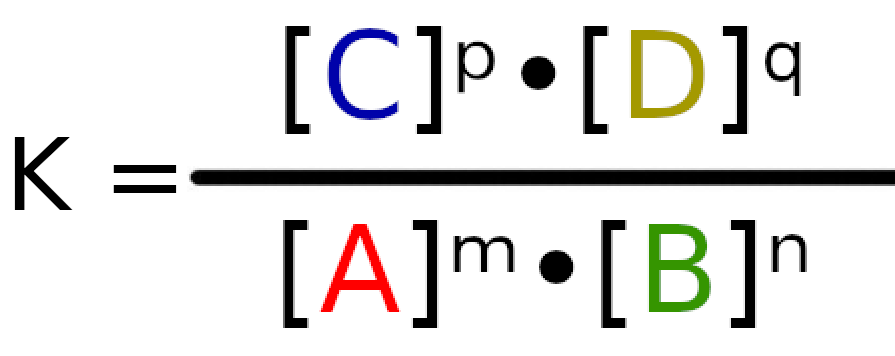
Podłóżmy standardowo dane pod wzór.
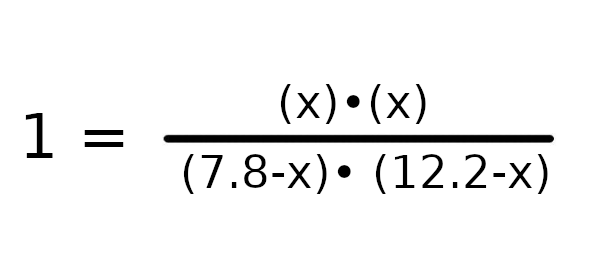
Mnożąc obustronnie przez mianownik otrzymujemy równanie, możemy sprowadzić równanie do postaci:
x² = (7,8 – x) * (12,2 – x)
x² = 95.16 – 7,8x – 12,2x + x²
0 = 95.16 – 20x
95.16 = 20x
x = ~4,8
Musimy udzielić odpowiedzi, ile moli wodoru było w reaktorze po ustaleniu stałej równowagi. A jest nim po prostu nasza wartość x z obliczeń.
Podsumowanie
Tak jak liczyliśmy w pierwszym artykule, jest niezwykle mało czasu na wykonanie każdego zadania, więc istotną rzeczą na maturze jest czytanie zadań ze zrozumieniem. Zdecydowanie lepiej jest przeznaczyć krótką chwilę na analizę zadania niż zrobić je źle i dostać za nie niepełne punkty lub ich w ogóle nie otrzymać.


0 Komentarzy