Wiązania chemiczne między atomami
W dzisiejszym artykule poruszymy temat wiązań chemicznych. Poznamy 4 najważniejsze wiązania w cząsteczkach i omówimy, krótko ich charakterystykę. Omówione definicje i przykłady będą omawianie na podstawie elektroujemności w skali Pauliego i są to tylko uproszczenia, ale właśnie takie modele są wymagane na maturze z chemii. Zapraszamy do czytania!
Definicja wiązania
Zastanówmy się na początku, czym właściwie jest wiązanie chemiczne i jak je zrozumieć?
Wiązanie chemiczne – najprościej ujmując, jest to trwałe połączenie atomów, w którym dochodzi do uwspólnienia elektronów.
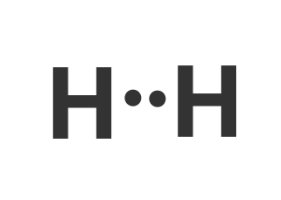
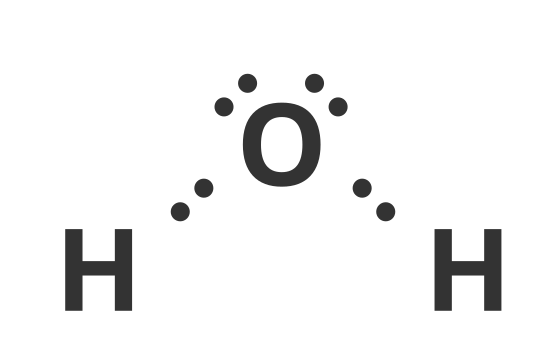
Na powyższych modelach dostrzegamy jak, elektrony z powłok walencyjnych tworzą wiązanie przez uwspólnione pary elektronów. Dzięki właśnie takim wiązaniom powstają twory, które nazywamy cząsteczkami chemicznymi. Naturą atomów jest to, że dążą do uzupełnienia swoich powłok walencyjnych. Wodór do uzupełnienia swojej powłoki walencyjnej potrzebuje tylko 2 elektronów, więc tworząc wiązanie z tlenem, uwspólnia z nim 1 elektron. Tlen natomiast potrzebuje ośmiu elektronów na swojej powłoce walencyjnej, więc jak widzimy na przykładzie cząsteczki wody, że tworzy wiązania z dwoma wodorami. Dowiemy się jednak o przypadkach, kiedy cząsteczki tworzą wiązania, mimo uzupełnia swoich powłok walencyjnych.
Rodzaje wiązań chemicznych
Rozróżniamy między innymi następujące wiązania:
- Kowalencyjne niespolaryzowane
- Kowalencyjne spolaryzowane
- Jonowe
- Koordynacyjne
Pierwsze 3 wiązania, rozróżniamy na podstawie elektroujemności atomów, między którymi zostają utworzone wiązania.
Kowalencyjne niespolaryzowane
Są to wiązania chemiczne, które są utworzone między atomami, które przyciągają z podobną siłą elektrony. Różnicy elektroujemności w takich w wiązaniach jest mniejsza niż 0,4. Przykładów takich cząsteczek jest mnóstwo: H2, O2, F2 lub nawet SiH4. W pierwszych trzech przykładowych cząsteczkach różnica elektroujemności wynosi 0, ale już w wiązaniach Si – H, różnica ta wynosi 0,3, czyli nadal uznajemy te wiązania za kowalencyjne niespolaryzowane.
Kowalencyjne spolaryzowane
Te wiązania charakteryzują się tym, że para elektronów jest bardziej przyciągana przez jeden z atomów. Różnicy elektroujemności w takich w wiązaniach jest w przedziale od 0,4 do 1,7. Przykład takich cząsteczek: H2O, HCl, NH3.
Jonowe
Te wiązania charakteryzują wyciągnięcie elektrony przez atom bardziej elektroujemny. Wiązania jonowe to takie, w których różnica elektroujemności wynosi wiece niż 1,7. Przykładami cząsteczek gdzie występuje takie wiązanie, jest Li2O, CaO, HF.
Te 3 podstawowe wiązania można uprościć do:
Kowalencyjne niespolaryzowane – mniej niż 0,4 elektroujemności. Para elektronów jest współdzielona w porównywalnym stopniu.
Kowalencyjne spolaryzowane – różnica elektroujemności wynosi między 0,4 a 1,7. Para elektronów jest skierowana do bardziej elektroujemnego atomu
Jonowe – różnica w elektroujemności musi wynosić powyżej 1,7. Atom, bardziej elektroujemny przejmuje elektron z drugie atomu. W cząsteczce przez występuję kation (atom, który oddał elektron) i anion (atom, który pobrał elektron).
Koordynacyjne
Wiązania koordynacyjne to rodzaj wiązań kowalencyjnych. Różnica polega na tym, że para elektronów z jednego z atomów zostaje udostępniona drugiemu atomu. Takie wiązanie możemy zapisać strzałką,
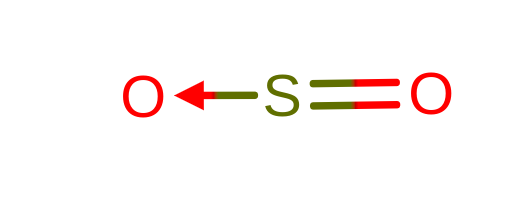
Na powyższym przykładzie (SO2) widzimy, że siarka tworzy wiązanie z tlenem, mimo że wystarczy jej utworzyć 2 wiązania, żeby mieć 8 elektronów w swojej powłoce walencyjnej.
Dzięki wiązaniom koordynacyjnym może również cząsteczka, które będzie jonem.
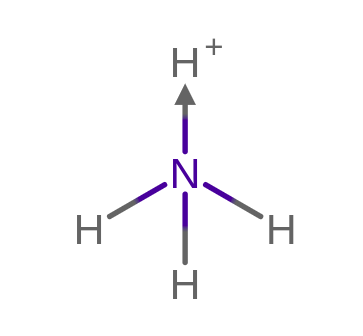
Azot w amoniaku (NH3) udostępnia swoją wolną parę elektronów, dzięki czemu Kation wodoru (H+), może uzupełnić swoją powłokę walencyjną, dzięki czemu powstaje jon NH4+.
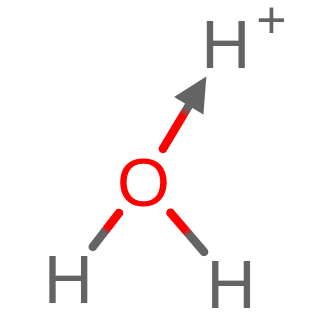
Podobne działanie występuje w cząsteczce wody. Wolna para elektronów współdzieli z kationem wodoru (H+) elektrony, dzięki czemu powstaje jon H3O+.
Podsumowanie
W dzisiejszych artykule poruszyliśmy podstawowe pojęcia wiązań i ich charakterystykę. Wiązań i oddziaływań w cząsteczkach jest więcej. Jedak te, które omówiliśmy, są najważniejsze i rozumienie ich poprzez różnice elektroujemności jest wymagane na maturze.



0 Komentarzy