Ułamkowe stopnie utlenienia
W dzisiejszym artykule omówimy, przypadki, w których atomy przyjmują ułamkowe stopnie utlenienia. Przeanalizujemy parę przykładów, bazując na założeniach z artykułu o wyliczaniu stopnia utlenienia. Może odetchnąć z ulgą, ponieważ te cząsteczki nie powinny się pojawić na arkuszach maturalnych. Jednak zrozumienie ich pomoże wam zrozumieć lepiej temat stopni utlenienia i przyda się przy zrozumieniu stopni utlenienia w cząsteczkach organicznych. Tak jak w każdym artykule, będziemy posługiwać się pojęciem elektroujemności w skali Pauliego.
Fe3O4
Zaczniemy od omawiania przykłady na tak zwanym tlenku żelaza(II) diżelaza(III) i byśmy przyjęli zasadę, że tlen przyjmuje zawsze -II stopień utlenienia, to dokonując obliczeń:
x = stopień utlenienia żelaza
-2 * 4 + 3 * x = 0
3x = 8
x = 22⁄3
Z obliczeń wynika, że poziom utlenienia żelazu musi być równy 22⁄3. Wygląda jak błąd, prawda? Cząsteczka nosi nazwę tlenku żelaza(II) diżelaza(III). Nazwa cząsteczki mówi nam wprost, że żelazo występuje tutaj na II i III stopniu utlenienia. Spójrzmy na jej budowę:
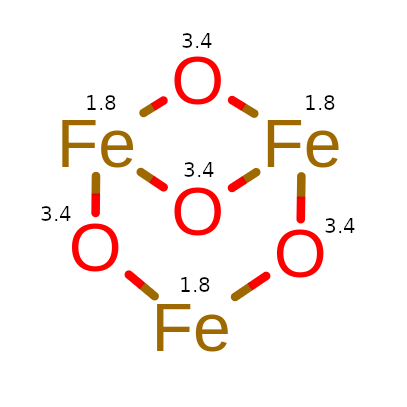
Widzimy, że jeden atom żelaza tworzy tylko 2 wiązania z tlenami i po poprawnym rozpisaniu stopni utlenienia w cząsteczce powinniśmy uświadomić sobie, czemu stopień utlenienia wynosi właśnie 22⁄3.
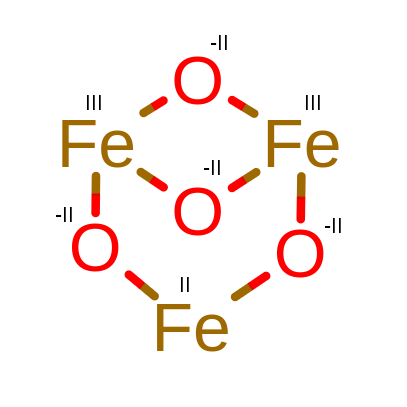
Czemu tak się dzieje? Fe3O4 to tak naprawdę mieszanka dwóch tlenków, tlenku żelaza(II) i tlenku żelaza(III). Możemy jej stopnie utlenienia zapisać jako FeO·Fe3O4 a jej stopnie utlenienia zapisać następujący sposób:
FeIIO-II·FeIII3O-II4.
Z takim zapisem łatwiej zrozumieć czemu w obliczeniach wychodzi nam taki stopień utlenienia i następnym razem powinno nam się nasunąć pytanie “Czy wszystkie atomy tworzą tyle samo wiązań?”.
Pb3O4
Na pierwszy rzut oka można pomyśleć, że sytuacja będzie wyglądało podobnie co w Fe3O4. Jednak i tym razem, będziemy zaskoczeni. Ołów (Pb), występuję w tej cząsteczce na II i IV stopniu utlenienia. Dlatego cząsteczka ta nosi też nazwę tlenek diołowiu(II) ołowiu(IV). Spójrzmy na budowę cząsteczki:
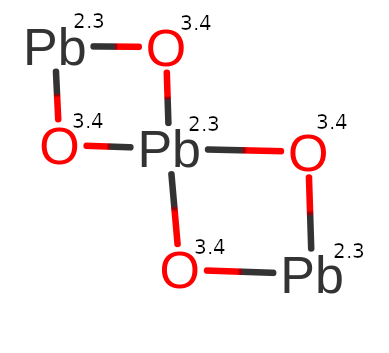
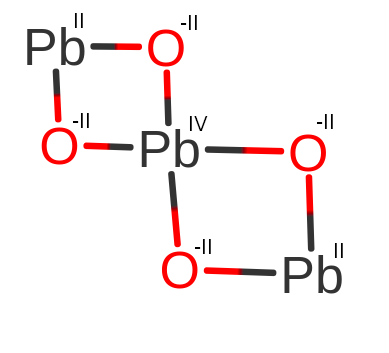
Widząc powyższe przykłady, możemy dojść do wniosku, że wzór sumaryczny nie będzie nigdy wskazywał jakie wiązania i jakie stopnie utlenienia przyjmują poszczególne atomy. Na podstawie prostych cząsteczek i tych, co do których mamy pewność jak reszty kwasowe.
H2S2O3
Ostatnim przykładem jest kwas tiosiarkowy. Jeżeli byśmy policzyli stopnie utlenienia w sposób standardowy, czyli zakładamy, że tlen jest na -II stopniu utlenienia i wodór na I, to obliczenia wychodziłyby następująco:
x = stopień utlenienia siarki
-2 * 3 + 2 * 1 + 2 * x = 0
2x = 4
x = 2
Czy rzeczywiście siarka jest na II stopniu utlenienia? Jeżeli przyjrzymy się budowie cząsteczki, to niestety nic się nie układa zgodnie z naszymi oczekiwaniami.
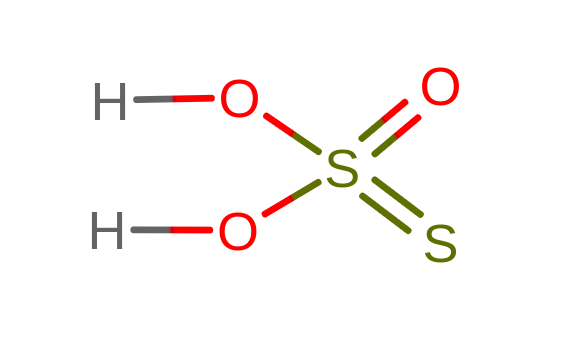
Co jest ciekawe w tej cząsteczce to to, że zależnie od źródła znajdziemy informacje na temat stopni utlenienia siarki w tym związku. Atomy siarki mogą przyjmować następujące wartości: –II i VI lub -I i V lub 0 i IV. Bazując na strukturze w powyższym przykładzie, siarki będą odpowiednio na 0 i IV stopniu utlenienia.
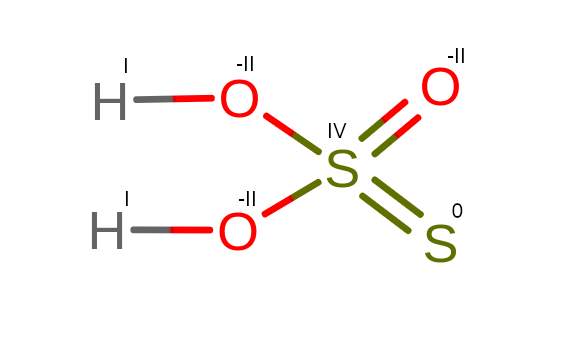
Wiele przykładów cząsteczek może nas zaskoczyć w podobne sposób, jeżeli byśmy chcieli obliczyć stopień utlenienia bazie wzoru sumarycznego.
Podsumowanie
Poznanie powyższych przykładów pomoże zrozumieć, jak faktycznie ustalany jest stopień utlenienia atomów w cząsteczkach i przyda się, gdy będziemy chcieli poznać stopnie utlenienia w cząsteczkach organicznych, co omówimy szerzej w najbliższych artykułach.



0 Komentarzy