Wyznaczanie stopnia utlenienia
Dzisiaj skupimy się na obliczaniu stopnia utlenienia pierwiastków w cząsteczkach chemicznych. Wytłumaczymy szczegółowo jak wyliczyć stopień utlenienia i czym różni się od wartościowości. Poznamy także różne przypadki, gdy atomy przyjmują nieintuicyjne wartości stopnia utleniania.
Na początek warto zapoznać się z podstawowymi regułami. Zasady te wymuszają poleganie na intuicji. Przez to, powody, dla których atomy przyjmują stopnie utleniania inne niż standardowe, mogą być niejasne. W tym artykule omawiamy takie przypadki.
Przed rozpoczęciem czytania warto przypomnieć sobie jakie wiązania tworzy atom. Należy także znać pojęcie jonu i elektroujemności.
Definicja stopnia utlenienia
Poznając temat najlepiej zacząć od zdefiniowania sobie, czym jest stopień utlenienia.
Jest to formalna wartość ładunku atomu w związku chemicznym przy założeniu, że wszystkie wiązania chemiczne w danej cząsteczce mają charakter wiązań jonowych. Suma stopni utlenienia w cząsteczce musi wynosić 0, a w jonach ma wartość ładunku jonu.
Elektroujemności wybranych pierwiastków są następujące:
– fluor (F): 4.0
– tlen (O): 3.4
– wodór (H): 2.2
Powyższe definicje omówimy na przykładzie H2O i HF.
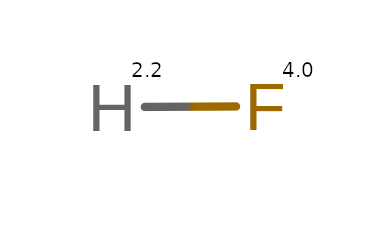
W wiązaniu jonowym H – F, gdzie różnica wynosi 1.8. Z tego względu, bardziej elektroujemny atom fluoru (F) wyciąga z wodoru (H) elektron i przyłącza go do siebie.
Dzieje się tak, gdy różnica elektroujemności między atomami wynosi więcej niż 1.7. Takie wyciąganie elektronu zmniejsza stopień utlenienia fluoru (F) do -I a wodór (H) zostaje utleniony do I stopnia.
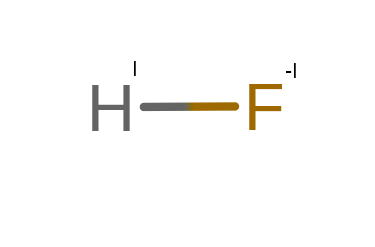
Powyższą cząsteczkę zapisujemy w postaci HI F-I.
Zgodnie z definicją, suma stopni utlenienia musi wynosić 0.
Kierując się powyższym, dodajmy do siebie stopnie w cząsteczce HF:
1 + (-1) = 0
Dzięki temu, że otrzymaliśmy zero, możemy wywnioskować, że wykonaliśmy obliczenia poprawnie.
Weźmy teraz pod lupę wiązania w cząsteczce wody H2O:
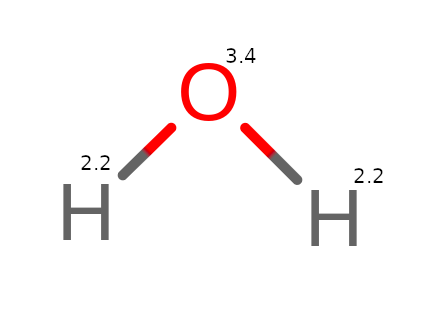
Na powyższym obrazku widzimy, że istnieją wiązania tylko między wodorem a tlenem (H – O). Różnica elektroujemności wynosi (3.4 – 2.2 = 1.2). W związku z tym, że różnica wynosi mniej niż 1.7, wiązanie to nie jest wiązaniem jonowym. Elektron wodoru nie jest zabierany przez tlen.
Z pomocą w obliczeniach przychodzi definicja, która głosi, że możemy założyć, że wszystkie wiązania chemiczne w danej cząsteczce mają charakter wiązań jonowych. Dzięki temu możemy uznać, że tlen pobiera elektron od wodoru. Przez to, spada poziom utlenienia tlenu, a wzrasta utlenienie wodoru. Jest to pewne uproszczenie, ale będziemy się nim posługiwać w trakcie obliczeń.
Obliczenie poziomu utlenienia w cząsteczce wody
Mamy dwa wiązania wodoru z tlenem (H – O). Uznajemy, że tlen pobiera z wodoru po jednym elektronie. Przez to, stopień utlenienia tlenu wynosi -II. Stopień utlenienia wodoru to wtedy I.
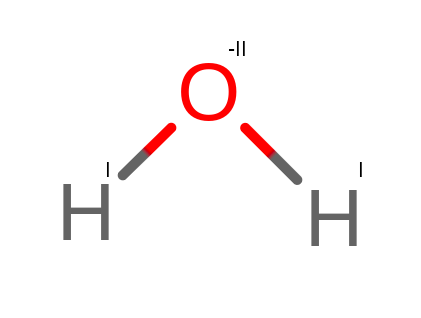
Powyższą cząsteczkę możemy zapisać w postaci HI2O-II.
Aby sprawdzić, czy suma stopni utlenienia w cząsteczce wynosi 0, musimy obliczyć poniższe równanie:
2 * 1 – 2 = 0
Z jonami sprawa jest zdecydowanie prostsza: ładunek jonu równa się stopniu utlenienia.
- K+ będzie na I stopieniu utlenienia
- Ca2+ będzie na II stopniu utlenienia
- Stopień utlenienia Cl– będzie wynosił -I
W dalszej części artykułu przeanalizujemy także takie jony jak (SO4)2-, czyli reszty kwasowe.
Możemy także wyciągnąć wnioski na podstawie cząsteczki wody i fluorowodoru. Każde wiązanie jest jonowe i pomaga w obliczaniu stopnia utlenienia, czyli formalnej wartości ładunku na atomie. Suma ładunków musi wynosić 0.
Nietypowe stopnie utlenienia
Nietypowymi przykładami możemy określić przypadki, których nie obejmują ustalone podstawowe reguły. Dzięki znajomości definicji rozprawimy się z takimi przykładami jak tlen przyjmujący wartość -I, I lub nawet II.
Zerowy stopień utlenienia
Na początek zastanówmy się, co dzieje się ze stopniami utlenienia w cząsteczkach takich jak H2, O2, F2, I2.
H – H
O = O
F – F
I – I
Widzimy, że wszystkie wiązania występują między tymi samymi atomami, a różnica elektroujemności wynosi 0. Gdybyśmy ściśle trzymali się definicji, uznalibyśmy, że każdy atom pobiera od innego atomu elektron. Przez to mają ten sam, zerowy bilans.
Powyższe cząsteczki zapisujemy w postaciach: H02, O02, F02, I02,
Przykładowe stopnie utlenienia tlenu (O)
-I
W cząsteczce nadtlenku wodoru (H2O2), przy założeniu, że tlen przyjmuje stopień utlenienia -II, wodór musiałby być na II stopniu utlenienia. Znając budowę atomu wodoru, wiemy, że nie może oddać tylu elektronów.
Przyjrzyjmy się wzorowi strukturalnemu H – O – O – H. W przeciwieństwie do cząsteczki wody występuje tu wiązanie O – O. To samo wiązanie występuje w O2, gdzie bilans elektronowy między atomami tlenu jest zerowy. Występują tu jednak wiązania wodór- tlen (H – O), ale między różnymi atomami tlenu. Z tego powodu każdy z tych atomów przyjmie tylko po jednym elektronie od wodorów. Ich stopienie utlenienia będą wynosiły tylko -I.
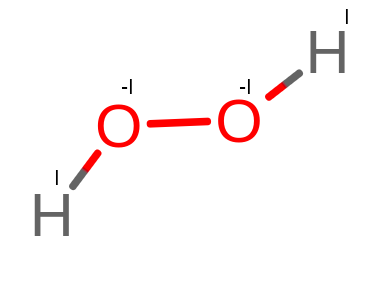
Powyższą cząsteczkę możemy zapisać następująco: HI2O-I2
Jej równanie stopnia utlenienia to 2 * 1 + 2 * (-1) = 0
I
Aby tlen przyjął dodatnią wartość, musi oddać elektron. Z tego powodu atom pobierający elektron musi mieć wyższą elektroujemność. Jedynym z takich przykładów jest, gdy tlen łączy się z fluorem z niewielką różnicą w elektroujemności (4.0 – 3.4 = 0.6). Cząsteczką, która może powstać, jest nadtlenek fluoru (F2O2). Ma ona podobny wzór strukturalny do H2O2.
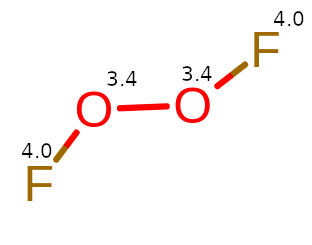
F – O – O – F w swojej strukturze zawiera też wiązanie O – O, ale wiązania F – O pozbawiają tlen z elektronu, utleniając go do I stopnia.
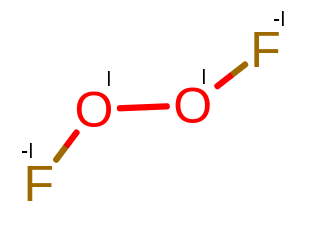
Powyższą cząsteczkę można zapisać następująco: F-I2OI2
Jej równanie stopnia utlenienia to: 2 * (-1) + 2 * 1 = 0
II
Znając powyższe przykłady, z łatwością znajdziemy cząsteczkę F2O, w której tlen ma II stopień utlenienia. Ma ona wzór strukturalny przypominający cząsteczkę wody, czyli F – O – F. Oba wiązania F – O z jednego tlenu fluor wyciągnie po jednym elektronie, utleniając go do II stopnia.
Taką cząsteczkę można zapisać następująco: F-I2OII
Jej równanie to: 2 * (-1) + 2 = 0
Stopnie utlenienia w resztach kwasowych
Sprawdźmy, jakie stopnie utlenienia przyjmie reszta kwasowa.
Omawianie zaczniemy od reszty SO42- nazywanej jonem siarczanowym. Jon ten może pochodzić od mocnego kwasu siarkowego (VI) H2SO4, którego cząsteczka w środowisku wodnym ulega dysocjacji, tworząc SO42- i H+.
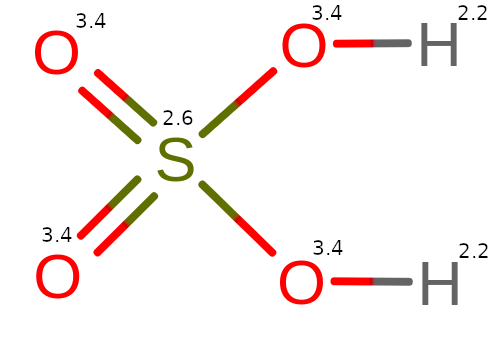
Spoglądając na budowę powyższego kwasu, widzimy, że tlen ma najwyższą elektroujemność. Tlen będzie podbierał elektrony od wodoru (H) i siarki (S).
Dwa podwójne wiązania O = S zabiorą cztery elektrony łącznie. Dwa pojedyncze wiązania O – S zabiorą kolejne dwa elektrony, utleniając siarkę do IV stopnia utlenienia.
Atomy tlenu, które mają pojedyncze wiązania z siarką, zabiorą elektrony od wodorów, z którymi mają pojedyncze wiązania.
Z powyższych powodów, tlen będzie miał -II stopień utlenienia. Wodór będzie miał I stopień, a siarka VI.
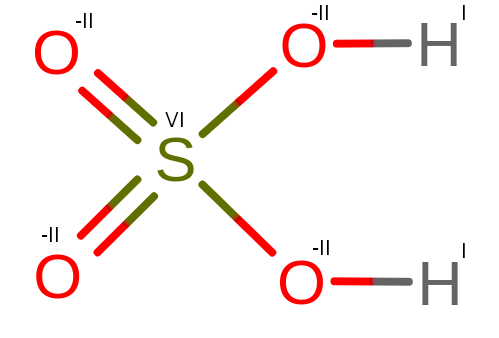
Powyższą cząsteczkę można zapisać w postaci: H2ISVIO4-II
Powyższa cząsteczka ma następujące równanie: 4 * (-2) + 6 + 2 * 1
Reszta kwasowa
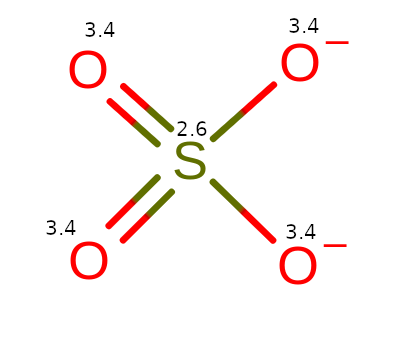
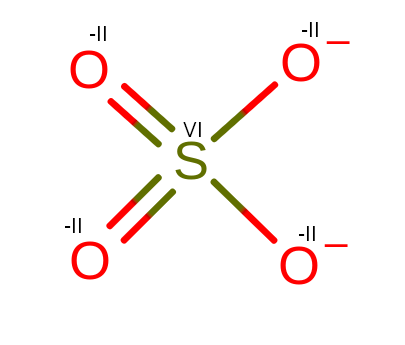
Porównajmy resztę kwasową do kwasu siarkowego VI. Zauważymy, że dwa tleny, które były połączone z wodorami, stały się anionami O–. Dzięki nim cząsteczka będzie mogła łączyć się z inną materią.
Przyda nam się tutaj rozróżnienie pojęć stopnia utlenienia i wartościowości.
Wartościowość określa liczbę wiązań chemicznych, z którymi dany pierwiastek lub jon może łączyć się z innymi.
Przykładowo, siarka na VI stopniu utlenienia może tworzyć sześć wiązań. Przez to, jej wartościowość to 6. Tlen na -II stopniu utlenienia również tworzy dwa wiązania.
Jednakże wartościowość nie jest przypisana do pierwiastka. W cząsteczce CO2 i CO, wartościowość węgla wynosi odpowiednio 4 i 2.
SO42- traktujemy jako jon o wartościowości 2, więc jest ona w stanie utworzyć dwa wiązania. Daje nam to wiedzę o wartościowości atomów, jakie tworzą wiązania z jonem. Wiemy, że sód ma stopień utlenienia I w cząsteczce Na2SO4, a bar w BaSO4 jest na II stopniu utlenienia.
Zapis sumaryczny Al2(SO4)3 mógł budzić pewne wątpliwości. Jednak teraz wiemy, że dwa atomy aluminium na III stopniu utlenienia potrzebują utworzyć łącznie sześć wiązań.
Podzielmy te sześć wiązań na dwa wiązania, które aluminium jest w stanie utworzyć z SO4. Po zrobieniu tego dochodzimy do wniosku, że aluminium potrzebuje trzech takich cząsteczek. Rozpisanie wzoru strukturalnego pomoże nam zrozumieć, czemu tak się dzieje.
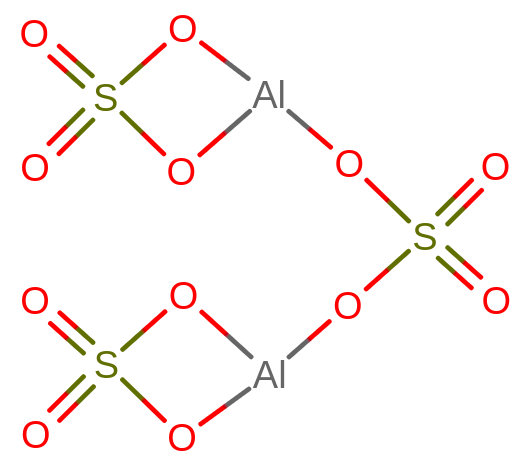
Zadania
Spróbujcie swoich sił, wypisując stopnie utlenienia w atomach podanych cząsteczek. Swoje wyniki możecie porównać z odpowiedziami.
1. CaS,
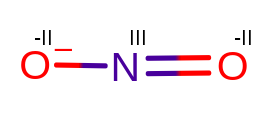
2. NO2–
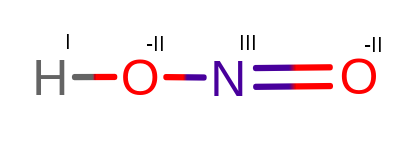
3. HNO2,
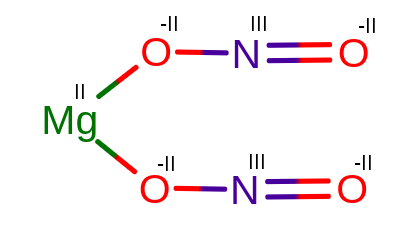
4. Mg(NO2)2,
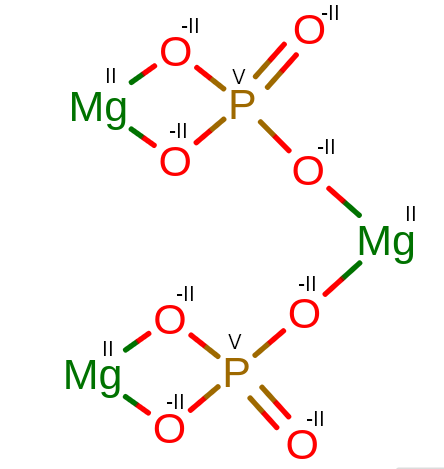
5 .Mg3(PO4)2,
1. CaIIS-II

2. NIIIO2-II –
3. HINIIIO2-II
4. MgII(NIIIO2-II)2
5. Mg3II(PVO5-II)2
Podsumowanie
W tym artykule poznaliśmy mechanizmy wyznaczania stopni utleniania. Dowiedzieliśmy się także, że nie zawsze należy kierować się podstawowymi zasadami ich obliczania. Dzięki temu możemy sobie poradzić z wieloma zadaniami z wyznaczania stopni utleniania. Rozwiązanie powyższych dodatkowych zadań pomoże utrwalić omówiony materiał.
W następnych artykułach postaramy się poruszyć więcej wątków dotyczących budowy cząsteczek. Napiszcie w komentarzach swoje sugestie, abyśmy dowiedzieli się, jakie tematy Was interesują.



0 Komentarzy